A definição de Brönsted-Lowry sobre ácidos e bases, proposta em 1923 por Johannes Nicolaus Brönsted e Thomas Martin Lowry, acaba sendo mais geral que a definição de ácidos e bases de Arrhenius, pois tira a restrição de só se referir a reações em solução aquosa.
No entanto, a definição de Brönsted-Lowry é restrita em sua finalidade, pois limita a discussão sobre o fenômeno ácido base nas reações de transferência de próton. Sem conta que existem muitas reações que tem todas as características de reações ácidos bases, mas não se ajustam a definição de Brönsted-Lowry. No mesmo ano em uma abordagem mais entendida, Gilbert Newton Lewis propõe uma definição que cobre todos estes casos.
Definição de Lewis de ácidos e bases
Segundo a definição de Lewis de ácidos e bases, a atenção principal é voltada para base. Uma base é definida como uma substancia que pode doar elétron para a formação de uma ligação covalente e, o acido é definido como uma substancia que pode aceitar um par de elétron pra formar uma ligação.
Um exemplo bem simples disso é uma reação acido-base de um próton com o íon hidróxido.
Nessa reação o íon hidróxido é uma base de Lewis, porque doa o par de elétrons para formar a ligação e, o íon hidrogênio é um acido de Lewis ,porque ele aceita o par de elétrons e a ligação entre os 2 é formada.
Outro exemplo é a reação entre BF3 E NH3:
Nessa reação o NH3 vai funciona como uma base e o BF3 como um ácido. Compostos com camadas de Valencia incompleta como o BF3 ou AlCl3, tendem a ser ácidos de Lewis, enquanto compostos ou íons que tenham pares de elétrons não compartilhados, podem comportar-se como bases de Lewis. Quando a reação ácido-base ocorre, é formada uma ligação covalente dativa (coordenada).
A formação de um composto químico pode ocorrer sem a interferência de qualquer quantidade de água, conforme o exemplo que é mostrado abaixo :
Na2O(s) + SO3(g) → Na2 SO4(s)
Segundo a definição de Lewis.Essa também é uma reação de neutralização entre uma base de Lewis (íon de óxido) e um acido de Lewis (trióxido de enxofre) :
Nessa reação deve ocorrer um novo rearranjo eletrônico, pois o oxigênio se liga ao enxofre. Assim ocorrendo a transformação total e, essa transformação total pode ser vista como uma reação de neutralização.
Reações deste tipo, são importantes na remoção de óxidos de enxofre dos gases produzidos pela combustão de combustíveis com alto teor de enxofre. A reação entre o Na2O e o SO3 é uma reação que mostra bem as limitações do conceito de Brönsted-Lowry, pois nenhum próton está envolvido na reação.
Reagentes nucleófilos e eletrófilos
Segundo a definição, uma base de Lewis é um composto químico que, em suas reações, procura um núcleo com o qual possa compartilhar um par de elétrons. Por isso é denominada nucleófilo (amante ou amigo do núcleo). Uma reação na qual uma base de Lewis desloca outra é chamada de um deslocamento nucleófilo. Deste ponto de vista, um número muito grande de reações química, incluindo todas as que ocorrem transferência de próton do tipo Brönsted-Lowry , também podem ser consideradas simplesmente como uma reação ácido-base, na qual uma base forte se desloca para uma mais fraca.
Existem também casos de reações de ácido-base, Onde um ácido de Lewis desloca outro mais fraco.
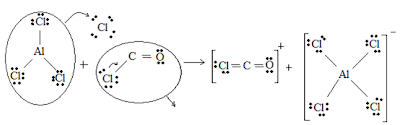
AlCl3 + COCl 2 → COCl+ + AlCl 4-
Nessa reação vemos ocorrer o deslocamento do ácido COCl+ pelo ácido mais forte o AlCl3.Em outras palavras, imaginamos a molécula COCl2 como sendo o “produto da neutralização” entre o ácido de Lewis COCl+ e a base de Lewis Cl- e é a base que troca de companheiro, quando a reação de deslocamento ocorre :
AlCl3 COCl 2 → [Cl3 Al . . . Cl- .. . COCl+] → AlCl4-+ COCl+
Uma vez que os ácidos de Lewis procuram substancias que tenham pare de elétrons com os quais podem se ligar, os ácidos de Lewis são chamados de eletrófilos (amante ou amigo de elétrons) e uma reação de deslocamento ácido recebe o nome de deslocamento eletrófilo. Embora a maioria das reações ácido-base em água sejam classificadas como deslocamentos nucleofílicos, as reações de deslocamento eletrofílico também são muito importantes e, muitas dessas reações são encontradas no curso de química orgânica.
Referências
- Química Geral Volume 2 , James E.Brady e Gerard E.Humiston -Livros tecnicos e cientificos editora S.A -1986
- https://quimica-dicas.blogspot.com.br/2010/06/teoria-de-lewis-para-acido-base.html ( Acessado em 13/06/2012 as 15:48)
- https://educacao.uol.com.br/quimica/acidos-e-bases-definicoes-de-arrhenius-bronsted-lowry-e-lewis.jhtm(Acessado em 13/06/2012 as 16:25)
Sobre o autor
 Olá meu nome é Pedro Coelho, eu sou engenheiro químico, engenheiro de segurança do trabalho e Green Belt em Lean
Six Sigma. Além disso, também sou estudante de engenharia civil, e em parte de minhas horas vagas me dedico a escrever artigos aqui no ENGQUIMICASANTOSSP, para ajudar estudantes de Engenharia Química e de áreas correlatas. Se você está curtindo essa postagem, siga-nos através de nossas paginas nas redes sociais e compartilhe com seus amigos para eles curtirem também :)
Olá meu nome é Pedro Coelho, eu sou engenheiro químico, engenheiro de segurança do trabalho e Green Belt em Lean
Six Sigma. Além disso, também sou estudante de engenharia civil, e em parte de minhas horas vagas me dedico a escrever artigos aqui no ENGQUIMICASANTOSSP, para ajudar estudantes de Engenharia Química e de áreas correlatas. Se você está curtindo essa postagem, siga-nos através de nossas paginas nas redes sociais e compartilhe com seus amigos para eles curtirem também :)
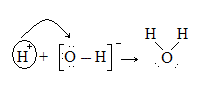
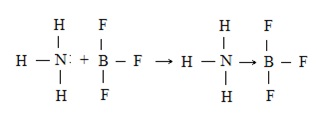


0 Comentários de "Ácidos e Bases de Lewis: Definição da teoria de Lewis"
Os comentários são sempre bem vindos, pois agregam valor ao artigo. Porém, existem algumas regras na Política de Comentários, que devem ser seguidas para o seu comentário não ser excluído:
- Os comentários devem estar relacionados ao assunto do artigo.
- Jamais faça um comentário com linguagem ofensiva ou de baixo calão, que deprecie o artigo exposto ou que ofenda o autor ou algum leitor do blog.
- Não coloque links de sites ou blogs no corpo do texto do comentário. Para isso, assine com seu Nome/URL ou OpenID.
-Não coloque seu email e nem seu telefone no corpo do texto do comentário. Use o nosso formulário de contato.
- Se encontrar algum pequeno erro na postagem, por favor, seja bem claro no comentário, pois a minha bola de cristal não é muito boa.
- Tem vezes que eu demoro pra responder, mas quase sempre eu respondo.
- Não seja tímido, se você tem alguma duvida ou sabe de algo mais sobre o assunto abordado no artigo, comente e compartilhe conosco :)