Desenvolvido pelo químico dinamarquês Johan Gustav Christoffer Thorsager Kjeldahl em 1883, o Método de Kjeldahl (também conhecido como Teste de Kjeldahl) é um procedimento de química analítica que é amplamente utilizado para determinar a quantidade de nitrogênio de alimentos, fertilizantes e outras substâncias.
 |
| Retrato do químico Johan G. C. T. Kjeldahl |
Esse método consiste essencialmente em transformar todo o nitrogênio de uma amostra em sulfato de amônio por digestão com ácido sulfúrico, alcalinizando a solução, e determinando a amônia resultante destilando-a em um volume medido de ácido padrão, e o excesso desta, do qual é determinado por titulação.
Entendendo o Método de Kjeldahl e a sua relação com as proteínas
O nitrogênio é um dos cinco principais elementos encontrados em materiais orgânicos, como por exemplo, as proteínas. Como vimos na introdução acima, o Método de Kjeldahl é um método de análise qualitativa de nitrogênio que é muito utilizado para o cálculo do teor de proteína em uma grande variedade de materiais, que vai desde alimentos para humanos e animais, fertilizantes, águas residuais e combustíveis fósseis.
O método de Kjeldahl consiste em três etapas:
- Digestão;
- Destilação;
- Titulação.
Etapa da digestão e os catalisadores que podem ser usados
Nessa etapa de digestão, ocorre a decomposição do nitrogênio presente nas amostras orgânicas através do uso de uma solução ácida bem concentrada, sendo isso geralmente realizado fervendo uma amostra homogênea em ácido sulfúrico concentrado.
O resultado final dessa etapa é uma solução de sulfato de amônio. A equação geral para a digestão de uma amostra orgânica é esta que está mostrada abaixo:
$\Pr \text{ote }\!\!\acute{\mathrm{i}}\!\!\text{ na +}~~{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}~~\to ~~{{\left( N{{H}_{4}} \right)}_{2}}S{{O}_{4}}_{\left( aq \right)}+C{{O}_{2}}_{\left( g \right)}+S{{O}_{2}}_{\left( g \right)}+{{H}_{2}}{{O}_{\left( g \right)}}$
O ácido sulfúrico é geralmente usado sozinho para a digestão de amostras orgânicas, e a quantidade de ácido necessária é influenciada pelo tamanho da amostra e quantidade relativa de carbono e hidrogênio na amostra, bem como a quantidade de nitrogênio. Além disso, uma amostra muito rica em gordura consome bem mais ácido.
Nessa etapa de digestão, a entrada de calor e o tempo da digestão influenciam a quantidade de perda de ácido devido à vaporização durante o processo de digestão. Além disso, as amostras orgânicas geralmente se carbonizam e escurecem no começo da digestão.
A reação pode a princípio ser muito demorada dependendo da matriz e da entrada de calor, e com a decomposição orgânica, a mistura da digestão desaparece gradualmente à medida que o CO2 evolui.
O problema do uso do ácido sulfúrico sozinho com muitas amostras é que a digestão pode demorar bastante tempo devido à baixa taxa de decomposição orgânica do mesmo. Por isso é recomendável fazer a adição de um sal inorgânico à digestão para elevar o ponto de ebulição do H2SO4.
Sendo que por si só, a temperatura da solução de ácido sulfúrico concentrado é de cerca de 330 °C, e com a adição de um sal tal como sulfato de potássio (K2SO4), a temperatura da solução da mistura de digestão pode se elevada a 390 °C ou mais, dependendo da proporção de sal para ácido.
Esse aumento da temperatura da solução faz com que a taxa de decomposição orgânica na mistura de digestão aumente significativamente, encurtando o tempo necessário para a digestão.
Além disso, existem várias precauções que nós devemos ter em mente antes da adição de algum sal. Primeiramente, se é possível elevar demais a temperatura da solução da mistura de digestão, pois, se a temperatura estiver bem acima de 400°C durante qualquer fase da digestão, os compostos de nitrogênio voláteis podem ser perdidos para a atmosfera e a análise da amostra final não vai ser precisa.
À medida que o ácido é gradualmente consumido durante o processo de digestão, pelas várias razões mencionadas acima, a proporção de ácido salino da digestão aumenta gradualmente. Isto significa que as temperaturas mais quentes da solução são atingidas no final da digestão, e a entrada de calor, o consumo de ácido por material orgânico e a vaporização, a relação sal / ácido, o tempo de digestão e projeto físico do Frasco de Kjeldahl, estão todos interrelacionados, e cada um tem um efeito na temperatura final da solução.
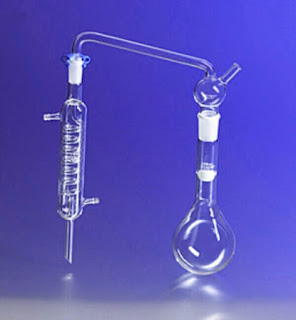 |
| O Frasco de Kjeldahl é um balão de fundo redondo com um pescoço longo e largo que é especificamente usado na determinação do teor de nitrogênio e de proteínas pelo Método de Kjeldahl |
Uma segunda precaução que nós devemos tomar é que, se a relação sal / ácido for muito alta, ocorrerá um fenômeno conhecido como “salting-out” (que é a insolubilização da proteína em decorrência de um considerável aumento da força iônica do meio) e uma quantidade considerável de material pode se precipitar ao esfriar o material digerido.
Com isso, bolsas de ácido concentrado podem ser contidas dentro de um bolo de proteína, e este material pode reagir violentamente quando a base concentrada é adicionada no processo de destilação. Quando isso ocorre, uma certa quantidade de água até pode ser administrada para diluir esse material enquanto ele ainda estiver um pouco , mas não muito quente.
Outro detalhe curioso dessa etapa do processo é que os químicos ao longo dos anos têm testado vários catalisadores para aumentar a taxa de degradação orgânica durante a digestão ácida. Nesses experimentos, eles viram que o óxido de mercúrio é um catalisador bem eficaz e por um tempo foi amplamente utilizado. No entanto, o mercúrio forma um complexo com íons de amônio durante a digestão, que oferece um risco de intoxicação aguda e de explosão.
A adição de tiossulfato de sódio ou de sulfeto de sódio após a digestão e antes da destilação ajuda a quebrar o complexo e a precipitar o sulfeto mercúrico. Isso também é importante do ponto de vista da segurança, pois o vapor de mercúrio pode escapar para a atmosfera durante o processo de destilação.
Por causa desses riscos ambientais com manuseio e descarte de mercúrio, outros catalisadores estão se tornando mais favoráveis, e muitos métodos hoje empregam sulfato de cobre. Além disso, em outros experimentos verificou-se que o óxido de titânio e o sulfato de cobre em combinação podem ser mais eficazes do que o sulfato de cobre isoladamente.
Etapa da destilação
Na destilação se adiciona o excesso de base à mistura de digestão ácida para converter NH4+ em NH3, seguido de fervura e condensação do gás NH3 em uma solução receptora, sendo isso realizado pela elevação do pH da mistura usando hidróxido de sódio (solução de NaOH). Isso tem o efeito de mudar os íons de amônio (NH4+) (que são dissolvidos no líquido) para amônia (NH3), que é um gás. Na equação a seguir vemos a reação da formação dessa amônia gasosa.
Depois é separado o nitrogênio da mistura de digestão, destilando a amônia (convertendo-a em um gás volátil, elevando sua temperatura até o ponto de ebulição) e então aprisionando os vapores destilados em uma solução especial de ácido bórico (H3BO3). A amônia é ligada ao ácido bórico na forma de complexo de borato de amônio.
A maior parte de NH3 destilada é retida na solução ácida receptora em um intervalo de 5 a 10 minutos do tempo de fervura. No entanto, dependendo do volume da mistura de digestão e do método a ser seguido, 15 a 150 ml de condensado devem ser coletados no frasco receptor para garantir a recuperação completa do nitrogênio.
Sendo que se houver uma extensão adicional dos tempos de destilação e volumes coletados, isso simplesmente resultará em mais água sendo transportada para a solução receptora. Além disso, o excesso de água não vai alterar os resultados da titulação.
Os tempos de destilação e os volumes de destilados coletados devem ser padronizados para todas as amostras de uma determinada metodologia. A taxa de destilação é afetada pela capacidade de resfriamento do condensador e pela temperatura da água de resfriamento, mas principalmente pela entrada de calor. Normalmente, os elementos de aquecimento usados para destilação têm controladores de temperatura variáveis.
Uma taxa de destilação de cerca de 7,5 ml / minuto é mais comumente citada nos métodos aceitos. A conexão de lâmpadas ou câmaras de expansão entre o frasco de digestão e o condensador é uma consideração importante para evitar a transferência da mistura de digestão alcalina para o frasco receptor, pois uma pequena contaminação da solução receptora pode causar um erro significativo na etapa de titulação. Quando níveis muito baixos de nitrogênio estão sendo determinados, e é aconselhável “pré-condicionar” o aparelho de destilação antes da destilação.
E para pré-condicionar o aparelho de destilação, você pode fazer isso destilando uma mistura 1:1 de água livre de amônia e 50% NaOH por 5 minutos antes da destilação da amostra para reduzir a contaminação da amônia atmosférica.
Etapa da titulação
Para fazer a titulação após a destilação existem dois métodos: Titulação de retorno e Titulação direta, mas o que seria esses dois tipos de titulação?
Titulação de retorno
Uma
titulação de retorno (também conhecida como titulação indireta) é um tipo de
titulação em que a concentração de um analito é determinada por reação com uma
quantidade conhecida de excesso de reagente,
Logo depois
esse reagente em excesso é titulado com um outro segundo reagente, e o
resultado dessa segunda titulação mostra quanto do excesso de reagente foi
usado na primeira titulação, permitindo assim que a concentração original do
analito fosse calculada.
Basicamente esse tipo de titulação é aplicado em titulações ácido-base:
- Quando o ácido ou (mais comumente) base é um sal insolúvel (por exemplo, carbonato de cálcio);
- Quando o endpoint - ou ponto final - de titulação direta seria muito difícil de discernir (por exemplo, ácido fraco e titulação de base fraca);
- Quando a reação ocorre muito lentamente.
- Esse tipo de titulação é geralmente aplicado, quando o endpoint é mais fácil de se ver do que com uma titulação normal, o que se aplica a algumas reações de precipitação.
Titulação de direta
A titulação direta é um tipo de titulação bem mais básica e simples que envolve a reação entre um composto desconhecido e um composto com concentração conhecida. Nessa titulação, a adição de reagentes em excesso não é feita como na titulação de retorno.
Aqui, o composto desconhecido reage diretamente com o composto conhecido. Portanto, o ponto final da titulação indica o fim da reação. Usando esse ponto final, a quantidade de composto desconhecido presente na solução de amostra pode ser determinada.
Vantagens e desvantagens do Método de Kjeldahl
O Método de Kjeldahl tem as seguintes vantagens:
- Aplicável a todos os tipos de alimentos;
- Relativamente bem simples;
- Não custa muito caro;
- Bem preciso, pois se trata de um método oficial para a determinação de nitrogênio em proteínas.
- Mede nitrogênio orgânico total, não apenas o nitrogênio das proteínas;
- Demorado;
- Utiliza reagentes corrosivos.
Referências
- https://www.britannica.com/science/Kjeldahl-method (acessado em 21/05/2019 às 18:48)
- http://users.metu.edu.tr/chem223/kjeldahl.pdf (acessado em 21/05/2019 às 19:00)
- https://www.chemistryworld.com/opinion/classic-kit-kjeldahl-flask/3004923.article (acessado em 25/05/2019 às 12:32)
- PURGATTO, Eduardo. Análise de Proteínas, FCF-USP, 2013.
- https://www.qualitybiological.com/product/pyrex_500ml_replacement_kjeldahl_flask__2942_standard_taper_joint/ (acessado em 27/05/2019 às 16:27)
- https://www.thoughtco.com/back-titration-definition-608731 (acessado em 29/05/2019 às 18:08)
- https://pediaa.com/difference-between-back-titration-and-direct-titration/#Direct%20Titration (acessado em 01/06/2019 às 19:49)
Sobre o autor
 Olá meu nome é Pedro Coelho, eu sou engenheiro químico, engenheiro de segurança do trabalho e Green Belt em Lean
Six Sigma. Além disso, também sou estudante de engenharia civil, e em parte de minhas horas vagas me dedico a escrever artigos aqui no ENGQUIMICASANTOSSP, para ajudar estudantes de Engenharia Química e de áreas correlatas. Se você está curtindo essa postagem, siga-nos através de nossas paginas nas redes sociais e compartilhe com seus amigos para eles curtirem também :)
Olá meu nome é Pedro Coelho, eu sou engenheiro químico, engenheiro de segurança do trabalho e Green Belt em Lean
Six Sigma. Além disso, também sou estudante de engenharia civil, e em parte de minhas horas vagas me dedico a escrever artigos aqui no ENGQUIMICASANTOSSP, para ajudar estudantes de Engenharia Química e de áreas correlatas. Se você está curtindo essa postagem, siga-nos através de nossas paginas nas redes sociais e compartilhe com seus amigos para eles curtirem também :)


4 Comentários de "Método de Kjeldahl – Teste para determinar o teor de nitrogênio e proteínas "
O Conteúdo foi extremamente útil. Muito obrigado
Entendi melhor o método. Valeu, Pedro!
Gostei muito da explicação do metodo. poderia me informar quantidde da amostra? em proporção? a amostra que preciso fazer é um extrato de uma planta.
Olá anônimo
As quantidades ideais de amostra variam geralmente de 0,01 a 5 g, e dependem dos teores de nitrogênio esperados, mas também não devemos esquecer que isso afeta a escolha da concentração do titulante. O limite da quantidade de amostra normalmente precisa ser encontrado experimentalmente, ou seja, você vai ter um pouco de trabalho nesses experimentos.
Os comentários são sempre bem vindos, pois agregam valor ao artigo. Porém, existem algumas regras na Política de Comentários, que devem ser seguidas para o seu comentário não ser excluído:
- Os comentários devem estar relacionados ao assunto do artigo.
- Jamais faça um comentário com linguagem ofensiva ou de baixo calão, que deprecie o artigo exposto ou que ofenda o autor ou algum leitor do blog.
- Não coloque links de sites ou blogs no corpo do texto do comentário. Para isso, assine com seu Nome/URL ou OpenID.
-Não coloque seu email e nem seu telefone no corpo do texto do comentário. Use o nosso formulário de contato.
- Se encontrar algum pequeno erro na postagem, por favor, seja bem claro no comentário, pois a minha bola de cristal não é muito boa.
- Tem vezes que eu demoro pra responder, mas quase sempre eu respondo.
- Não seja tímido, se você tem alguma duvida ou sabe de algo mais sobre o assunto abordado no artigo, comente e compartilhe conosco :)