Desenvolvida por Friedrich Wilhelm Ostwald em 1909, a Lei da Diluição de Ostwald (também chamada só de Lei de Ostwald) é uma lei que relaciona a concentração da solução com o grau de ionização do eletrólito.
 |
| Retrato de Friedrich Wilhelm Ostwald |
Para entendermos essa lei, suponhamos a dissociação de um eletrólito do tipo AB, onde inicialmente dispomos n mols:
O grau de ionização do eletrólito é dado por α, que é definido como o número de mols de eletrólito ionizados sobre o número de mols dissolvidos. Portanto:
Representando, ainda, o volume da solução por V (em litros) e a concentração molar por n/V, teremos:
Substituindo a expressão n/V por M (molaridade), temos:
O que resulta na expressão final:
Esta expressão permite ver claramente quais são os fatores que afetam o grau de ionização de um eletrólito e como são influenciados.
Se a temperatura aumentar, o Ki aumentará; e como a concentração molar M se mantém constante, o fator α2/1-α aumentará e consequentemente, α também.
Uma ideia dessa variação pode ser dada por: t > > > → α> >
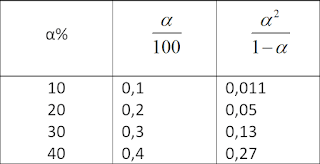
É interessante notar que um grande aumento do fator α2/1-α implica em um pequeno aumento do α. Inversamente, um pequeno aumento do grau de dissociação acarreta um grande aumento de α2/1-α. Isso porque, aumentando-se α, o numerador α2 torna-se maior, ao passo que o denominador 1-α diminui.
Essa variação pode ser analisada na tabela abaixo, em que vemos o α aumentar de 10 em 10%.
Quando a temperatura permanece constante, mas a concentração molar M diminui (por exemplo, em uma diluição), o fator α2/1-α sofre um aumento. Como consequência, o grau de ionização α também aumenta, só que em menor intensidade.
Logo: M < < < → α >>. Quando a concentração tende a zero, α tende para 1 ou 100 %.
Exemplos de exercícios de aplicação
1) Em uma solução 0,02M de ácido nitroso, a porcentagem de moléculas ionizadas é 15%. Qual a concentração de dissociação do ácido nitroso?
Resolução:
Sabemos que o M = 0,02 e que o α é igual a 0,15, assim, temos:
${{K}_{i}}=\frac{M{{\alpha }^{2}}}{1-\alpha }~\Rightarrow \frac{0,02.{{\left( 0,15 \right)}^{2}}}{1-0,15}={{5,3.10}^{-4}}$
2) Qual será a molaridade da solução do exercício anterior se o grau de dissociação for para 20%?
Resolução:
Sabemos que o Ki é 5,3. 10-4 e que o α é igual 0,2, logo temos:
${{K}_{i}}=\frac{M{{\alpha }^{2}}}{1-\alpha }~\Rightarrow {{5,3.10}^{-4}}=\frac{M{{\left( 0,2 \right)}^{2}}}{1-0,2}\Rightarrow M=0,01$
Na resolução dos exercícios, vemos que quando o grau de dissociação subiu 5%, a concentração da solução caiu em 50%.
Referências
- Luiz Carlos Roque da Silva; Ruy Lopes Pereira; Victor A.Petrucci - Curso Vestibular - Química e Biologia.
- Notas de Química Geral, Pedro Coelho, Santos, São Paulo, 2011.
Sobre o autor
 Olá meu nome é Pedro Coelho, eu sou engenheiro químico, engenheiro de segurança do trabalho e Green Belt em Lean
Six Sigma. Além disso, também sou estudante de engenharia civil, e em parte de minhas horas vagas me dedico a escrever artigos aqui no ENGQUIMICASANTOSSP, para ajudar estudantes de Engenharia Química e de áreas correlatas. Se você está curtindo essa postagem, siga-nos através de nossas paginas nas redes sociais e compartilhe com seus amigos para eles curtirem também :)
Olá meu nome é Pedro Coelho, eu sou engenheiro químico, engenheiro de segurança do trabalho e Green Belt em Lean
Six Sigma. Além disso, também sou estudante de engenharia civil, e em parte de minhas horas vagas me dedico a escrever artigos aqui no ENGQUIMICASANTOSSP, para ajudar estudantes de Engenharia Química e de áreas correlatas. Se você está curtindo essa postagem, siga-nos através de nossas paginas nas redes sociais e compartilhe com seus amigos para eles curtirem também :)

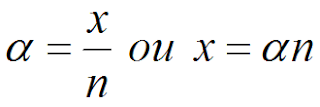
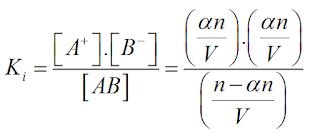
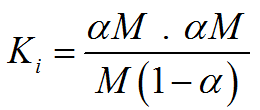


0 Comentários de "Lei da Diluição de Ostwald: Exercícios Resolvidos"
Os comentários são sempre bem vindos, pois agregam valor ao artigo. Porém, existem algumas regras na Política de Comentários, que devem ser seguidas para o seu comentário não ser excluído:
- Os comentários devem estar relacionados ao assunto do artigo.
- Jamais faça um comentário com linguagem ofensiva ou de baixo calão, que deprecie o artigo exposto ou que ofenda o autor ou algum leitor do blog.
- Não coloque links de sites ou blogs no corpo do texto do comentário. Para isso, assine com seu Nome/URL ou OpenID.
-Não coloque seu email e nem seu telefone no corpo do texto do comentário. Use o nosso formulário de contato.
- Se encontrar algum pequeno erro na postagem, por favor, seja bem claro no comentário, pois a minha bola de cristal não é muito boa.
- Tem vezes que eu demoro pra responder, mas quase sempre eu respondo.
- Não seja tímido, se você tem alguma duvida ou sabe de algo mais sobre o assunto abordado no artigo, comente e compartilhe conosco :)