Elaborada por Adolf Eugen Fick em 1855, a Lei de Fick para difusão molecular (ou transporte molecular) pode ser definida como a transferência (ou deslocamento) de moléculas individuais através de um fluido por meio de um deslocamento individual e desordenado das mesmas por um fluxo.
 |
| Retrato de Adolf Eugen Fick |
Nesse contexto, podemos imaginar que as moléculas se movem em uma linha reta e, quando mudam a sua direção, várias dessas moléculas acabam saltando e se colidindo com as outras. Esse movimento desordenado e aleatório das moléculas é chamado, geralmente, de Difusão Molecular (também podendo ser chamado de Processo com Trajetória Aleatória).
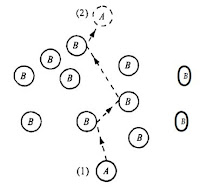 |
| Esquema do Processo de Difusão Molecular |
Na figura acima é representado esquematicamente o processo de difusão molecular. Neste esquema é mostrado o caminho desordenado que a molécula A faz do ponto 1 até o ponto 2 para se difundir através das moléculas de B.
Caso houvesse mais moléculas de A em torno do ponto 1 do que no ponto 2, as moléculas de A começariam a se difundir de forma desordenada, logo, haveria mais moléculas de A se difundindo de (1) para (2) do que (2) para (1), pois, na difusão líquida, as moléculas da região mais concentrada tendem a migrar para a região onde tem menos de sua concentração, para que haja um equilíbrio.
Pegando um outro exemplo, quando se adiciona uma gota de tinta azul em um copo de água. Notamos que as moléculas de tinta se difundem lentamente em todas as partes de água por difusão molecular, podendo esse processo ser acelerado através de uma agitação mecânica, que pode ser feita através de uma colher.
Só que nessa agitação, notamos que existe a presença de dois mecanismos, os mecanismos de transferência de massa e de calor (condução e convecção). Logo, podemos dizer que esses mecanismos de transferência de calor são análogos à difusão molecular e a transferência convectiva de massa.
Quando o fluido se encontra inteiramente imóvel (estado estacionário), a difusão molecular se deve a um gradiente de concentração.
Para uma mistura binária de A e B, a equação geral da Lei de Fick pode ser escrita como:
${{J}_{az}}=-c{{D}_{AB}}\frac{d{{x}_{A}}}{dz}~~~~\left( 1 \right)$
... em que “c” é a concentração total de A e B em Kg mol A+B/m3 e “ xA” é a fração molar de A em uma mistura de A e B.
Se “c” é constante, então CA=CxA:
$Cd{{x}_{A}}=d\left( c{{x}_{A}} \right)=d{{C}_{A}}~~~~~\left( 2 \right)$
Substituindo (2) em (1), obtém-se a equação (3) para uma concentração total constante:
${{J}_{az}}=-{{D}_{AB}}\frac{d{{C}_{A}}}{dz}~~~~\left( 3 \right)$
Exemplo de exercício de aplicação da Lei de Fick
1) Uma mistura gasosa de He e N2 está contida em um tubo a 298K (25°C) e 1 atm de pressão total e constante. No ponto 1 , Pa1 de He é de 0,6 atm e no ponto 2, a 20 cm de distância, a Pa2 é de 0,2 atm. Determine o fluxo de He, no regime permanente, para DAB= 0,687.10-4 m2/s
Dado: Constante dos gases perfeitos R= 82,057.10-3 m3atm/kmol K
Resolução:
${{J}_{AB}}=-{{D}_{AB}}\frac{d{{C}_{A}}}{dz}\Rightarrow {{J}_{AB}}dz=-{{D}_{AB}}d{{C}_{A}}\Rightarrow $
Integrando os dois lados
Observação: Caso você não saiba fazer esse tipo de integração, eu recomendo que você dê uma olhada na nossa postagem de Integral Definida.
$\Rightarrow {{J}_{AB}}\int\limits_{z1}^{z2}{dz}=-{{D}_{AB}}\int\limits_{{{C}_{A}}1}^{{{C}_{A}}2}{d{{C}_{A}}}\Rightarrow {{J}_{AB}}=\frac{-{{D}_{AB}}\left( {{C}_{A2}}-{{C}_{A1}} \right)}{z2-z1}\Rightarrow $
$\Rightarrow {{J}_{AB}}=\frac{{{D}_{AB}}\left( {{C}_{A1}}-{{C}_{A2}} \right)}{z2-z1}$
Como a pressão total é constante, o a concentração total também é, logo, a mistura gasosa cumpre a Lei dos Gases Ideais.
$PV=nRT$
Isolando P e igualando a equação a C:
$\frac{n}{V}=\frac{P}{RT}=C$
Substituindo as concentrações pelas pressões:
${{J}_{AB}}=\frac{{{D}_{AB}}\left( \frac{{{P}_{A1}}}{RT}-\frac{{{P}_{A2}}}{RT} \right)}{z2-z1}\Rightarrow {{J}_{AB}}=\frac{{{D}_{AB}}\left( {{P}_{A1}}-{{P}_{A2}} \right)}{RT\left( z2-z1 \right)}$
Calculando JAB:
${{J}_{AB}}=\frac{{{D}_{AB}}\left( {{P}_{A1}}-{{P}_{A2}} \right)}{RT\left( z2-z1 \right)}=\frac{\frac{{{0,687.10}^{-4}}{{m}^{2}}}{s}\left( 0,6-0,2 \right)atm}{82,057~.~~{{10}^{-3}}\frac{{{m}^{3}}atm}{Kmol~K}298K\left( 20cm\frac{1m}{100cm} \right)}={{5,62.10}^{-6}}\frac{Kmol~A~}{s.{{m}^{2}}}$
Contradifusão Equimolar em Gases
Na figura abaixo é mostrado um diagrama para os gases A e B, onde P é a pressão total das duas câmaras grandes que estão conectadas por um tubo que serve para verificar a difusão molecular no estado estacionário. As duas câmaras possuem uma agitação que mantém as suas concentrações uniformes. A pressão parcial PA1 > PA2 e PB2> PB1.
As moléculas de A se difundem para a direita e as de B para a esquerda. A pressão total de P é constante em todo o sistema, logo os mols de A que se difundem para a direita devem ser iguais aos mols de B que se difundem para a esquerda, pois se não for assim, a pressão total não se manterá constante. Isso quer dizer que:
${{J}_{AZ}}=-{{J}_{BZ}}$
 |
| Contradifusão Equimolar de gases A e B |
${{J}_{B}}=-{{D}_{BA}}\frac{d{{C}_{B}}}{dz}$
Agora, uma vez que P = PA + PB = constante, temos:
$C={{C}_{A}}+{{C}_{B}}$
Diferenciando em ambos os lados:
$d{{C}_{A}}=-d{{C}_{B}}$
Igualando a equação de JA com a de JB:
${{J}_{A}}=-{{D}_{AB}}\frac{d{{C}_{A}}}{dz}=-{{J}_{B}}=-\left( - \right){{D}_{BA}}\frac{d{{C}_{B}}}{dz}$
Substituindo DCA e cancelando os termos iguais:
${{D}_{AB}}={{D}_{BA}}$
Isto mostra que para uma mistura gasosa binária de A e B, o coeficiente de difusividade DAB para difusão de A em B é igual à DAB, que é o coeficiente de difusão de B em A.
Exemplo de exercício de Contradifusão Equimolar
2) Em um tubo de 0,10 m de comprimento há difusão de amônia gasosa (A) em nitrogênio (N2) gasoso (B) a 1,0132.105 Pa de pressão a 298 K (25°C). No ponto 1 a pressão é de 1,013.104 Pa e no ponto 2 a pressão é de 0,507.104 Pa, e a difusividade DAB é 0,230.10-4m2/s.
Dado: Constante R = 8314,3 m3 Pa / Kmol K
a) Calcule o fluxo especifico JA em estado estacionário
b) Calcule o fluxo especifico JB em estado estacionário
Resolução:
Calculando JA
${{J}_{A}}=\frac{{{D}_{AB}}\left( {{p}_{A1}}-{{p}_{A2}} \right)}{RT\left( {{z}_{2}}-{{z}_{1}} \right)}=\frac{\left( {{0,23.10}^{-4}}{{m}^{2}}/s \right).\left( 1,013-0,507 \right){{.10}^{4}}Pa}{8314,3\frac{{{m}^{3}}Pa}{Kmol~K}.298K.\left( 0,1-0 \right)m}={{4,70.10}^{-7}}\frac{Kmol~A}{s~~{{m}^{2}}}$
Cálculo de PB1
${{P}_{B1}}=P-{{P}_{A1}}={{1,0132.10}^{5}}Pa-{{1,013.10}^{4}}Pa={{9,1190.10}^{4}}Pa$
Cálculo de PB2
${{P}_{B2}}=P-{{P}_{A2}}={{1,0132.10}^{5}}Pa-{{0,507.10}^{4}}Pa={{9,625.10}^{4}}Pa$
Calculando JB
${{J}_{B}}=\frac{{{D}_{AB}}\left( {{p}_{B1}}-{{p}_{B2}} \right)}{RT\left( {{z}_{2}}-{{z}_{1}} \right)}=\frac{\left( {{0,23.10}^{-4}}{{m}^{2}}/s \right).\left( 9,119-9,625 \right){{.10}^{4}}Pa}{8314,3\frac{{{m}^{3}}Pa}{Kmol~K}.298K.\left( 0,1-0 \right)m}=-{{4,70.10}^{-7}}\frac{Kmol~B}{s~~{{m}^{2}}}$
Como o valor de JB deu negativo, isso significa que o fluxo vai do ponto 2 para o ponto 1.
Referências
- Operaciones de Tranferencia de Masa, 2°Edicion, Robert E. Treybal, McGraw-Hill
- Procesos de Transporte y Operaciones, 3°Edicion, C.J. Geankoplis Compañía Editorial Continental, S.A. De C.V, Mexico, 1998.
- Notas de aula de transferência de massa, Paulo Roberto Canton, Unisanta, Santos, São Paulo, 2012.
Sobre o autor
 Olá meu nome é Pedro Coelho, eu sou engenheiro químico, engenheiro de segurança do trabalho e Green Belt em Lean
Six Sigma. Além disso, também sou estudante de engenharia civil, e em parte de minhas horas vagas me dedico a escrever artigos aqui no ENGQUIMICASANTOSSP, para ajudar estudantes de Engenharia Química e de áreas correlatas. Se você está curtindo essa postagem, siga-nos através de nossas paginas nas redes sociais e compartilhe com seus amigos para eles curtirem também :)
Olá meu nome é Pedro Coelho, eu sou engenheiro químico, engenheiro de segurança do trabalho e Green Belt em Lean
Six Sigma. Além disso, também sou estudante de engenharia civil, e em parte de minhas horas vagas me dedico a escrever artigos aqui no ENGQUIMICASANTOSSP, para ajudar estudantes de Engenharia Química e de áreas correlatas. Se você está curtindo essa postagem, siga-nos através de nossas paginas nas redes sociais e compartilhe com seus amigos para eles curtirem também :)

1 Comentários de "Lei de Fick para Difusão Molecular"
obrigado pela ajuda!!
Os comentários são sempre bem vindos, pois agregam valor ao artigo. Porém, existem algumas regras na Política de Comentários, que devem ser seguidas para o seu comentário não ser excluído:
- Os comentários devem estar relacionados ao assunto do artigo.
- Jamais faça um comentário com linguagem ofensiva ou de baixo calão, que deprecie o artigo exposto ou que ofenda o autor ou algum leitor do blog.
- Não coloque links de sites ou blogs no corpo do texto do comentário. Para isso, assine com seu Nome/URL ou OpenID.
-Não coloque seu email e nem seu telefone no corpo do texto do comentário. Use o nosso formulário de contato.
- Se encontrar algum pequeno erro na postagem, por favor, seja bem claro no comentário, pois a minha bola de cristal não é muito boa.
- Tem vezes que eu demoro pra responder, mas quase sempre eu respondo.
- Não seja tímido, se você tem alguma duvida ou sabe de algo mais sobre o assunto abordado no artigo, comente e compartilhe conosco :)